Cách học thuộc dãy điện hóa
Dãy điện hóa là gì?
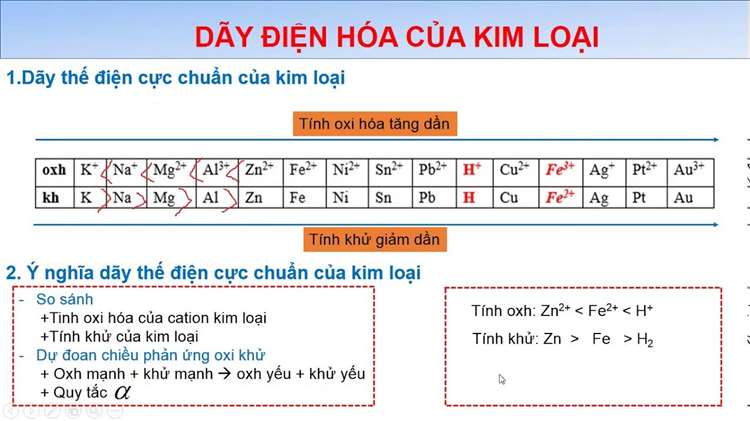
Dãy điện hóa (còn gọi là dãy hoạt động của kim loại) là bảng sắp xếp các kim loại theo khả năng mất electron, hay khả năng bị oxi hóa. Nói cách khác, dãy điện hóa xếp các kim loại từ kim loại mạnh nhất (dễ bị oxi hóa nhất) đến kim loại yếu nhất (khó bị oxi hóa hơn).
Kim loại đứng trên cùng: K, Na, Ca, Li…
Dễ bị oxi hóa mạnh, phản ứng nhanh với nước, axit hoặc muối của kim loại yếu hơn.
Kim loại đứng dưới cùng: Au, Pt, Ag…
Khó bị oxi hóa, hầu như không phản ứng với nước hoặc axit loãng.
Ngoài kim loại, dãy điện hóa còn giúp xếp một số ion và chất oxi hóa, thể hiện mức độ dễ bị khử của các chất này.
Vai trò của dãy điện hóa trong hóa học
Dãy điện hóa là công cụ quan trọng giúp dự đoán và giải thích các phản ứng hóa học. Cụ thể:
a. Dự đoán phản ứng thế của kim loại
Kim loại đứng cao hơn trong dãy có thể thay thế kim loại đứng thấp hơn trong hợp chất.
Ví dụ:
Zn+CuSO4 → ZnSO4+Cu
Vì Zn đứng trên Cu trong dãy điện hóa, Zn dễ bị oxi hóa và thế Cu ra khỏi muối.

Dãy điện hóa là gì và có vai trò gì trong hóa học?b. Xác định chất bị oxi hóa và chất bị khử
Oxi hóa (mất electron):
Zn → Zn² ⁺+2 e⁻
Fe → Fe² ⁺+2 e⁻
Khử (nhận electron):
Cu² ⁺+2 e⁻ → Cu
Fe³ ⁺+e⁻ → Fe² ⁺
Tổng phản ứng oxi hóa – khử:
Zn+Cu² ⁺ → Zn² ⁺+Cu
c. Tính toán hiệu điện thế của pin điện hóa
Dùng dãy điện hóa để tính hiệu điện thế chuẩn của các pin, áp dụng trong sản xuất pin và ắc quy.
Ví dụ pin Zn – Cu:
Cực âm (oxi hóa): Zn → Zn² ⁺+2 e⁻
Cực dương (khử): Cu² ⁺+2 e⁻ → Cu
Tổng phản ứng: Zn+Cu² ⁺ → Zn² ⁺+Cu
d. Ứng dụng thực tiễn khác
Chống ăn mòn kim loại: Chọn kim loại bảo vệ (hi sinh) dựa trên vị trí trong dãy.
Dự đoán phản ứng với nước, axit, muối:
Na phản ứng mạnh với nước
Ag hầu như không phản ứng
Chọn vật liệu trong công nghiệp:
Kim loại bền dùng làm điện cực, dây dẫn, hay vật liệu chống oxi hóa.
Để ghi nhớ dãy điện hóa nhanh và hiệu quả, bạn cần kết hợp mẹo trí nhớ, hình ảnh trực quan và luyện tập thường xuyên. Dưới đây là một hướng dẫn chi tiết:
Hiểu bản chất trước khi học thuộc
Dãy điện hóa là bảng xếp kim loại theo khả năng bị oxi hóa: kim loại đứng trên dễ bị oxi hóa, kim loại đứng dưới khó bị oxi hóa.
Hiểu rõ tính chất của từng nhóm kim loại sẽ giúp bạn nhớ lâu hơn.
Kim loại kiềm (K, Na, Li… ) rất phản ứng với nước và axit.
Kim loại quý (Au, Pt, Ag) gần như không phản ứng.
Khi hiểu bản chất, việc học thuộc sẽ trở nên tự nhiên và logic, thay vì chỉ “ học vẹt” .
Làm thế nào để ghi nhớ dãy điện hóa một cách nhanh nhất?Chia nhỏ và học theo nhóm
Chia dãy điện hóa thành các nhóm:
Kim loại mạnh nhất: K, Na, Ca, Li
Kim loại trung bình: Mg, Al, Zn, Fe, Ni, Sn, Pb
Kim loại yếu/ít phản ứng: Cu, Hg, Ag, Pt, Au
Học theo từng nhóm và ghi nhớ đặc trưng của nhóm đó.
Ví dụ: nhóm kim loại mạnh+phản ứng với nước → dễ nhớ, nhóm kim loại yếu+ít phản ứng → dễ nhớ.
Vẽ sơ đồ trực quan
Vẽ dãy điện hóa dạng thang hoặc mũi tên từ dễ oxi hóa → khó oxi hóa.
Màu sắc:
Kim loại phản ứng mạnh → màu đỏ
Kim loại ít phản ứng → màu xanh hoặc vàng
Khi nhìn sơ đồ, bạn hình dung trực quan, não nhớ nhanh hơn học chữ.
Luyện tập bằng phản ứng thực tế
Viết ra các phương trình hóa học để thấy kim loại nào thay thế kim loại nào:
Zn+CuSO4 → ZnSO4+Cu
Fe+CuSO4 → FeSO4+Cu
Làm bài tập liên tục giúp não tự ghi nhớ vị trí kim loại trong dãy.
Học theo chu kỳ và ôn lại
Học 10– 15 phút mỗi ngày thay vì học 1 lần quá dài.
Ôn lại sau 1 ngày, 3 ngày, 1 tuần → ghi nhớ dài hạn.
Dưới đây là những cách học thuộc dãy điện hóa dễ nhớ, đặc biệt phù hợp cho học sinh và sinh viên, kết hợp cả trí nhớ logic, hình ảnh và luyện tập:
Hiểu bản chất trước khi học thuộc
Cách học thuộc dãy điện hóa: Nhận biết rằng dãy điện hóa xếp kim loại từ dễ bị oxi hóa → khó bị oxi hóa.
Hiểu tính chất từng nhóm kim loại:
Kim loại mạnh: K, Na, Ca → phản ứng mạnh với nước, axit.
Kim loại trung bình: Zn, Fe, Ni → phản ứng với muối kim loại yếu hơn.
Kim loại yếu/ít phản ứng: Cu, Ag, Au → hầu như không phản ứng.
Khi hiểu cơ chế, việc học thuộc sẽ trở nên logic và dễ nhớ hơn.
Chia nhóm và học theo từng phần
Chia dãy điện hóa thành 3– 4 nhóm và học theo nhóm:
Kim loại mạnh: K, Na, Ca, Li
Kim loại trung bình: Mg, Al, Zn, Fe, Ni, Sn, Pb
Kim loại yếu: H, Cu, Hg, Ag, Pt, Au
Mỗi nhóm học kèm tính chất nổi bật → não ghi nhớ dễ hơn.
Vẽ sơ đồ trực quan
Vẽ thang dãy điện hóa, kim loại dễ oxi hóa đứng trên, khó oxi hóa đứng dưới.
Dùng màu sắc để phân biệt nhóm:
Kim loại mạnh → màu đỏ
Kim loại trung bình → màu cam
Kim loại yếu → màu xanh
Hình ảnh trực quan giúp nhớ nhanh hơn chữ viết.
Học qua phương trình hóa học
Thực hành các phản ứng kim loại – muối hoặc kim loại – axit:
Zn+CuSO4 → ZnSO4+Cu
Fe+CuSO4 → FeSO4+Cu
Mg+2 HCl → MgCl2+H2↑
Na+H2O → NaOH+H2↑
Khi thấy kim loại nào thay thế kim loại nào, não sẽ tự ghi nhớ thứ tự trong dãy.
Ôn tập theo chu kỳ
Học 10– 15 phút mỗi ngày thay vì nhồi nhét một lần.
Ôn lại sau 1 ngày, 3 ngày, 1 tuần → ghi nhớ lâu dài.
Kết hợp trò chơi và flashcard
Viết kim loại lên flashcard, tập xếp thứ tự đúng.
Tạo trò chơi đoán kim loại nào thay thế kim loại nào → học mà không thấy nhàm chán.

Làm bài tập liên quan đến dãy điện hóa cần lưu ý gì?Dưới đây là những lưu ý quan trọng khi làm bài tập liên quan đến dãy điện hóa. Nếu nắm vững các điểm này, bạn sẽ giải bài nhanh, chính xác và tránh nhầm lẫn:
Nắm rõ thứ tự các kim loại trong dãy điện hóa
Đây là điều quan trọng nhất. Khi biết kim loại nào mạnh hơn, kim loại nào yếu hơn, bạn sẽ dễ dàng xác định:
Kim loại nào bị oxi hóa
Kim loại nào bị khử
Kim loại nào thay thế được kim loại nào trong dung dịch muối
Ví dụ:
Zn đứng trước Cu → Zn có thể đẩy Cu ra khỏi CuSO₄.
Kim loại đứng trước có tính khử mạnh hơn
Kim loại càng đứng trên dãy điện hóa → dễ mất e⁻, dễ bị oxi hóa → tính khử mạnh.
Kim loại đứng dưới → tính khử yếu.
Điều này giúp bạn xác định chiều của phản ứng oxi hóa – khử.
Quy tắc phản ứng thế
Một kim loại đứng trước sẽ thay thế kim loại đứng sau trong muối của nó.
Ví dụ hợp lệ:
Fe+CuSO4 → FeSO4+Cu
Ví dụ không xảy ra:
Cu+FeSO4 → (không phản ứng)
Phản ứng với nước và axit
Kim loại rất mạnh (K, Na, Ca, Li, Mg) phản ứng với nước.
Kim loại nhóm trung bình (Fe, Zn… ) không phản ứng với nước nhưng phản ứng với axit loãng.
Kim loại yếu (Cu, Hg, Ag, Au) không phản ứng với axit loãng.
Ví dụ:
Mg+2HCl → MgCl2+H2↑ (có phản ứng)
Cu+HCl → không phản ứng
Viết đúng phương trình ion – electron
Nhiều bài yêu cầu lập phương trình oxi hóa – khử, nên cần phân biệt:
Oxi hóa: mất electron
Zn → Zn² ⁺+2e⁻
Khử: nhận electron
Cu² ⁺+2e⁻ → Cu
Khi ghép phương trình phải cân bằng số e⁻ hai vế.
Chú ý trạng thái của chất
Nhiều bạn nhầm lẫn giữa:
Dung dịch muối (dễ phản ứng)
Kim loại dạng rắn (không phải lúc nào cũng phản ứng)
Ion tự do và kim loại tự do
Luôn kiểm tra ký hiệu:
Cu² ⁺ (ion) ≠ Cu (kim loại rắn)
Không nhầm lẫn H với kim loại
Trong dãy điện hóa có H, nhưng H không phải kim loại.
H chỉ dùng làm mốc so sánh tính khử.
Ví dụ:
Kim loại đứng trước H → đẩy được H⁺ tạo H₂
Kim loại đứng sau H → không tạo khí H₂
Lưu ý bài tập tính toán
Khi bài yêu cầu tính:
khối lượng kim loại sinh ra
thể tích H₂
số mol e⁻ trao đổi
hiệu suất phản ứng
→ phải dựa trên phương trình ion – electron và dãy điện hóa để biết phản ứng có xảy ra hay không trước khi tính.
Trên đây chúng tôi đã trình bày chi tiết các cách học thuộc dãy điện hóa nhanh nhất và hiệu quả nhất. Với những mẹo ghi nhớ, phương pháp học theo nhóm, câu ghi nhớ, sơ đồ trực quan cũng như các lưu ý khi làm bài tập, hy vọng bài viết sẽ giúp bạn hiểu sâu hơn về dãy điện hóa và dễ dàng áp dụng vào việc học cũng như làm bài. Chúc bạn học tốt và nắm vững kiến thức hóa học một cách nhẹ nhàng và lâu bền !