Cách học thuộc dãy điện hóa
Dãy điện hóa của kim loại là dãy gồm những cặp oxi hóa khử của kim loại được được sắp xếp theo chiều tăng dần tính oxi hóa của ion kim loại và giảm dần theo tính khử của kim
Cu ( 2+) + 2e ⇔ Cu
Ag( + ) + 1e ⇔ Ag
Ví dụ 1:
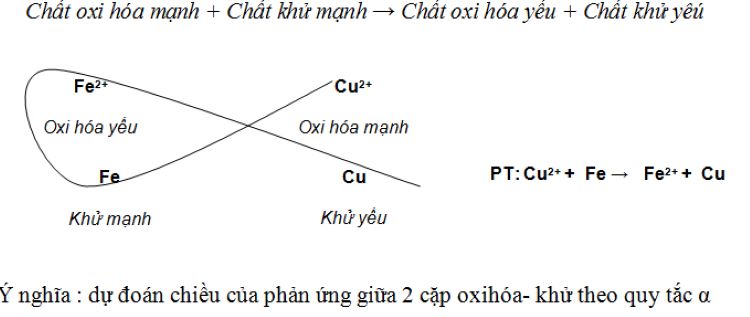
Cho đinh sắt vào dung dịch CuSO4, có phản ứng: Fe + Cu ( 2+ ) → Fe ( 2+ ) +Cu
Ngược lại cho Cu vào dung dịch FeSO4 sẽ không phản ứng.
→ Kết luận: Fe có tính khử mạnh hơn Cu; Và Cu ( 2+) có tính oxi hóa mạnh hơn Fe ( 2+ )

Chiều phản ứng của kim loại
Ví dụ 2:
Cho Cu vào dung dịch AgNO3, phương trình phản ứng:
Cu + 2 Ag (+) → Cu ( 2+ ) + 2 Ag
Ngược lại cho Ag vào dung dịch Cu(NO3)2 thì không xảy ra phản ứng
→Kết luận: tính khử Cu mạnh hơn so với Ag; tính oxi hóa Ag ( + ) mạnh hơn so với Cu ( 2+).
Từ hai thí nghiệm trên ta kết luận:
- Tính khử : Fe > Cu > Ag
- Tính oxi hóa: Fe (2+) < Cu (2+) < Ag ( + )
>> Tham khảo: Đề thi tuyển sinh lớp 10 môn anh đồng nai
Dựa vào dãy điện hóa đầy đủ, chúng ta có thể xác định được tính chất hóa học, và xác định được tính oxi hóa và tính khử.
3.1. Tác dụng với phi kim
Một số kim loại trong dãy điện hóa kim loại có tham gia phản ứng với phi kim để tạo ra các muối tương ứng. Một số phi kim thường gặp đó là oxi, clo, lưu huỳnh khi tác dụng với kim loại sẽ tạo ra các muối kết tủa.
Chẳng hạn:
Phản ứng với Clo: 2 Fe + Cl2 → 2 FeCl3
Phản ứng với oxi : 4 Al + O2 → 2 Al2O3
Phản ứng với lưu huỳnh : Hg + S → HgS
3.2. Tác dụng với dung dịch axit
Nhiều kim loại tác dụng với các dung dịch axit và tạo ra muối kết hợp giải phóng khí hoặc nước. Tuy nhiên với một số kim loại sẽ không phản ứng với axit.
Khi kim loại tác dụng với dung dịch HCl, H2SO4 loãng thì kim loại sẽ khử H+ tạo H2
Chẳng hạn: Fe + 2HCl → FeCL2 + H2
Khi kim loại tác dụng với dung dịch HNO3, H2SO4 đặc thì kim loại sẽ khử N ( +5 ), S ( +6 ) xuống với số mức oxi hóa thấp hơn
Chẳng hạn: 3 Cu + HNO3 → 3 CuSO4 + 2 NO + 4 H2O
3.3. Phản ứng với nước
Với các kim loại nhóm IA, IIA phản ứng với nước sẽ tạo ra một dung dịch kiềm và khí hidro.
Ví dụ: 2Na + 2H20 → 2 NaOH + H2
3.4. Tác dụng với dung dịch muối
Phản ứng kim loại tác dụng với muối thể hiện tính chất kim loại mạnh hơn sẽ đẩy kim loại yếu hơn ra khỏi muối đó và tạo thành muối mới và kim loại mới
Ví dụ: Fe + CuSO4 → FeSO4 + Cu
So sánh với tính oxi hóa - khử: Tính oxi hóa của ion M ( n+) càng mạnh thì tính khử của kim loại M sẽ càng yếu và chiều ngược lại. Cụ thể kim loại Na có tính khử mạnh, ion Na + có tính oxi hóa yếu. Ion Ag + có tính oxi hóa mạnh do đó kim loại Ag có tính khử yếu.
Xác định chiều phản ứng oxi hóa - khử : Dãy điện hóa của kim loại cho phép dự đoán ra chiều của phản ứng giữa các cặp oxi hóa - khử theo quy tắc alpha: Phản ứng giữa hai cặp oxi hóa - khử xảy ra theo chiều chất oxi mạnh hơn sẽ oxi hóa chất khử mạnh hơn. Phản ứng sinh ra oxi hóa yếu hơn và chất khử yếu hơn.
Để xét một phản ứng oxi hóa - khử có thể xảy ra hay không cần áp dụng quy tắc alpha: Chất khử mạnh + chất oxi hóa mạnh → chất oxi hóa yếu hơn + chất khử yếu hơn.
 Tính chất cơ bản của Kim loại
Tính chất cơ bản của Kim loạiDưới đây là Cách học thuộc dãy điện hóa dễ thuộc mời bạn tham khảo:

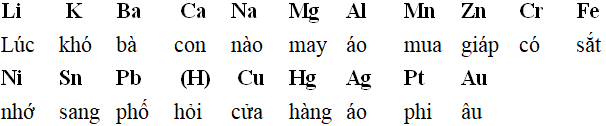

Cách thuộc dãy điện hóa dễ nhớSau khi nắm được Cách học thuộc dãy điện hóa, dưới đây là các dạng bài để các em học sinh tham khảo:
Dạng 1: Kim loại tác dụng với nước (H20)
* Phương pháp giải
a, Kim loại mạnh: nhóm IA và IIA ( trừ Be sẽ không khử được nước, Mg khử chậm ). Các kim loại còn lại sẽ khử mạnh nước ở nhiệt độ thường và giải phóng H2.
Phương trình phản ứng: 2 M + 2n H2O → 2 M ( OH)n + n H2
b, Kim loại trung bình: Fe, Zn,... khử được hơi nước với môi trường nhiệt độ cao.
c, Kim loại yếu : Cu, Ag, Au,.. không khử được nước dù trong nhiệt độ cao.
- Để giải được bài tập có thể viết phương trình và tính theo phương trình hoặc áp dụng định luật bảo toàn nguyên tố, bảo toàn electron và bảo toàn khối lượng.
Dạng 2: Kim loại tác dụng với các axit HCl, H2SO4 loãng
* Phương pháp giải
Viết phương trình hóa học rồi tính theo phương trình hóa học.
Kim loại + HCl/ H2SO4 loãng → Muối + H2
Chú ý: Chỉ với các kim loại đứng trước H trong dãy điện hóa thì mới phản ứng được với HCl, H2SO4 loãng
Ngoài ra, cũng có thể áp dụng các định luật bảo toàn sau:
- Bảo toàn nguyên tố Hidro:
n ( HCl ) = 2 n ( H2 )
n ( H2SO4 ) = n ( H2 )
→ Hỗn hợp 2 loại axit : n ( HCl ) + 2 n ( H2SO4 ) = 2 n ( H2 )
- Bảo toàn khối lượng:
m ( kim loại ) + m ( H2 ) + m ( axit ) = m ( muối )
Và m ( muối ) = m ( kim loại ) + m ( gốc axit )
- Bảo toàn khối lượng electron: tổng số mol e nhường = tổng số mol e nhận
Dạng 3: Kim loại tác dụng với muối
Viết phương trình hóa học theo như thứ tự phản ứng ( Nếu nhiều kim loại, nhiều muối phản ứng ) và tính theo phương trình phản ứng hóa học.
- Kim loại mạnh ( Na, K, Ba, Ca ): Ban đầu kim loại có tác dụng với nước
Sau đó sẽ tác dụng với dung dịch muối với điều kiện có kết tủa, bay hơi hoặc các chất điện ly yếu
- Các kim loại trung bình và yếu: Kim loại đứng trước sẽ đẩy kim loại đứng sau ra khỏi dung dịch muối.
Lưu ý: Các trường hợp cần nhớ sau:
Muối Fe ( 2+ ) phản ứng với muối Ag ( + )
Fe ( 2+ ) + Ag ( + ) → Fe ( 3+ ) + Ag
Fe phản ứng với muối Fe ( 3+ ) thì tạo ra muối Fe ( 2+ )
Fe + 2 Fe ( 3+ ) → 3 Fe ( 2+ )
Ngoài ra, cũng có thể áp dụng phương pháp tăng giảm khối lượng và bảo toàn electron.
Lời kết:
Với những nội dung chi tiết về Cách học thuộc dãy điện hóa trên, hy vọng bạn đã có những thông tin bổ ích. Đừng quên theo dõi và cập nhật những bài viết thú vị của thietbiantoanminhkien.com nhé!
>> Tham khảo sản phẩm: Bồn rửa mắt khẩn cấp gắn tường